Snake Pipe with Hand Ring - Motion Wellness by Xccent Fitness
Innholdsfortegnelse:
- Hva er en hybrid lukket loop?
- Minimert 670G Produktspesifikasjoner
- Tilgjengelighet og kostnad
- "En Watershed Moment … Transforming Diabetes Care"
- FDA godkjenner Libre Pro
- Ansvarsfraskrivelse
Wow, et stort øyeblikk for Diabetes-fellesskapet!
FDA godkjente onsdag Medtronic Minimed 670G, det første "hybrid closed loop system" som automatisk kan overvåke glukose og justere basale insulindoser hos mennesker 14 år og eldre med type 1 diabetes.

Mens vi i Diabetes-fellesskapet innser at det ikke er en fullstendig sløyfe AP som tar over diabeteskontrollen helt, og Medtronic selv er forsiktig med å referere til det som en "hybrid", den nye Minimert 670G representerer et stort skritt videre i å automatisere vår sykdomsbehandling. Woot!
Her er det offisielle brev fra FDA til Medtronic om denne godkjenningen, samt FDA-pressemeldingen.
Bemerkelsesverdig kommer denne regulatoriske godkjenningen bare 104 dager (!) Etter at Medtronic sendte tusenvis av sider med dokumenter, som er sju måneder tidligere enn forventet, og denne godkjenningen er mer enn et tiår med forskning, politikk, og produktutvikling for å komme til denne milepælen.
"Dette er fenomenalt, og jeg er så psyched! "Sier Aaron Kowalski, Chief Mission Officer for JDRF og longtime Type 1 selv. "Det er utrolig å være på dette nivået. Tenk på det - dette er første gang en av disse (automatiserte systemer) er godkjent … og den korte tiden det tok FDA å fjerne dette. "
Så, hva er dette nye glukose kontrollsystemet, og hvordan virker det?
Hva er en hybrid lukket loop?
Begrepet "hybrid" betyr i dette tilfellet at systemet er delvis automatisert, men krever fortsatt litt kontroll av brukeren.
Måten den fungerer på, er at CGM-sensoren leser glukosedata hvert femte minutt, og den lukkede algoritmen som er innebygd i pumpen, bruker den informasjonen til å øke eller redusere basisk insulin for å holde glukosenivåene så nær som mulig for målet på 120 mg / dL. Brukere trenger fortsatt å legge inn karbontall og bolusmengder for måltider, og varsle systemet før enhver øvelse. Det gir ikke automatisk korrekturboluser basert på CGM, men det foreslår korreksjonsbeløp når et fingerstickresultat er angitt akkurat som alle standard insulinpumper gjør nå gjennom Bolus Wizard-funksjonen.
< ! - 1 ->Denne FDA-siden gjør en fin jobb som forklarer detaljene. MiniMed 670G-systemet har to moduser, en ekstra "autopilot" enn den andre, men begge krever brukerintervensjon (dermed ikke en fullstendig sløyfe):
Manuell modus - der systemet kan programmeres av bruker å levere basal insulin til en forhåndsprogrammert konstant hastighet.Systemet vil automatisk suspendere levering av insulin dersom sensorens glukoseverdi faller under eller forventes å falle under en forutbestemt grense. Systemet vil også automatisk gjenoppta leveranse av insulin når sensorens glukoseverdier stiger over eller antas å stige over en forhåndsbestemt grense.
Automatisk modus - Systemet kan automatisk justere basalinsulin ved kontinuerlig økning, reduksjon eller suspensjon av leveranse av insulin basert på CGM-verdier (forskjellig fra manuell modus der basalt insulin leveres ved en konstant sats). Selv om Automodus automatisk kan justere basal insulinlevering uten inntasting fra brukeren, , må brukeren fremdeles manuelt levere insulin under måltider.
Dette er en ny type enhet som aldri tidligere er sett på markedet - og det faktum at den er godkjent her i USA først, før du slår på europeiske og internasjonale markeder, kan nesten ikke overdrevet.
Minimert 670G Produktspesifikasjoner
Utover ser Minimed 670G nesten ut som selskapets nylig godkjente Minimed 630G som gir en ny vertikal orientering og fargeskjermvisning til Medtronic standardpumpedesign.

Den store forskjellen er at denne insulinpumpen-CGM-kombinasjonen styres av en sofistikert algoritme. Medtronic dubser sin "SmartGuard Hybrid Closed Loop-teknologi", som kan gjøre de automatiske justeringene til basalt insulin og automatisk avstenging når det trengs. Produktspesifikasjonene er som følger:
- Pumpeenhet: Som nevnt, er utseendet det samme som Minimed 630G introdusert bare forrige måned (allerede foreldet?). Samme AA-batteri, samme infusjonssett og 300-enheters insulinreservoar, og litt større enn de tradisjonelt utformede Minimed-pumper med horisontal orientering. I motsetning til eldre Medtronic-pumper, tilbys denne enheten bare i svart, men du kan kjøpe en rekke forskjellige skinn for å jazz opp utseendet hvis ønskelig.
- Knapper og menyer: De eneste små forskjellene mellom 630G og den nye MiniMed 670G er at øverste høyre knapp tar deg direkte til CGM-grafer, i motsetning til banen til Menyer, og selve menyen varierer litt , gitt de nye modusvalgene, etc., på det nye systemet.
- Fargeskjerm: I likhet med 630G, har det nye systemet også en lys fargeskjerm (!) Som automatisk justerer seg til belysningssituasjoner, slik at det for eksempel ikke lyser så lyst som det kan i løpet av dagen. Dette ser ut til å være mye lettere å lese, en stor fordel for alle med synshandlinger selvfølgelig. Ved siden av grunnleggende pumpe- og CGM-data vises Insulin on Board (IOB) rett på hjemmeskjermen - noe brukerne har klamret seg på.
- CGM Tech: Det nye systemet bruker Medtronics fjerde generasjon skjellformede CGM-sensor, som ble referert til som Enlite 3, men vil nå bli kjent som Guardian 3-sensoren ( vi har en oversikt over alle de forskjellige Medtronic-vilkårene over på Storify ). Det blir slettet av FDA å ha på kroppen i 7 dager, sammenlignet med 6 dager for tidligere generasjoner.Ingenting er nytt på limfronten, skjønt.

- Forbedret nøyaktighet: Guardian 3 er mer pålitelig og nøyaktig, sier Medtronic, fordi den bruker et nytt radiosignal (introdusert med 630G) for å kommunisere mellom senderen og sensoren. Ifølge selskapets kliniske pivotale forsøksdata ved to kalibreringer per dag er MARD-feilfrekvensen i gjennomsnitt 10. 55%, som ikke er så god som den nyeste Dexcom G5 på 9%, men er mye bedre enn de 14% nåværende Enlite har å tilby - så det er en potensiell spillveksler for å gjøre Medtronic til en sterkere konkurrent i CGM-markedet!
- Din modus kan variere: Medtronic sier det lyttet til folk om ønsket valg, slik at det tillater at bytte mellom moduser: Auto Mode for hybrid closed loop-funksjonen eller Manuell modus som fortsatt tilbyr funksjonen Suspend on Low for Når du krysser den hypotrærmen (som 530G og 630G begge har), og Suspend Before Low som kan settes til å forutse hypos 30 minutter før de skjer (som i internasjonalt tilgjengelig 640G).

- Set BG Target: Denne teknologien er designet for å "behandle-til-mål", noe som betyr at den virker for å holde BG-nivåene nærme som mulig til 120 mg / dL. Dessverre kan det ikke endres … hvilket betyr at Medtronic bare tar "tilpassing og tilpasning" så langt. Brukeren kan stille et midlertidig mål på 150 mg / dL i opptil 12 timer for å håndtere situasjoner som trening, men det er den eneste fleksibiliteten som er bygget inn. Medtronic sier dette var et resultat av å prøve å komme til markedet først bety mye større kliniske studier som ville ha forsinket regulatorisk godkjenning og kommersialisering. Fremtidige generasjoner vil trolig tillate varierende målnivåer, sier Medtronic.
- Ingen datadeling: Som det tidligere Minimed 630G-systemet, har denne 670G Hybrid Closed Loop ikke innebygd Bluetooth og vil ikke fungere med Minimed Connect for datadeling av mobiltelefoner ( ?!). For dem som ønsker datadeling, peker Medtronic på deres Minimed 530G-system som nå er mer enn tre år gammel. Som følge av denne mangelen på tilkobling, vil 670G ikke fungere sammen med noen av IBM Watson- eller datadeling-mobilappene under utvikling.
- Tilkoblet BG Meter: Systemet er satt opp for å kommunisere direkte med Bayer Contour Link 2. 4 Meter som Ascensia introduserte med 630G lanseringsmeldingen. Dette gjør det mulig for fjernstyring fra måleren, men bare når i manuell modus i stedet for i lukket modus automatisk modus.
- To kalibreringer daglig: Systemet krever minst en fingerstickkalibrering hver 12. time, og hvis den ikke er skrevet, sparker den automatisk brukeren ut av Auto Mode.
- One-Press Serter: 670G bruker Medtronics nye One-Press Serter som sier at det vil gjøre sensorinnsetting enklere og mer behagelig. Det krever bare en enkelt knapp trykk, sammenlignet med tidligere generasjon serter som var bulkiert og krevde to knappetrykk (en gang for å sette inn og en gang for å trekke seg tilbake).
- Barn og tenåringer: Minimert 670G er offisielt merket i alderen 14 og eldre, men selskapet sier at det allerede utfører forsøk for godkjenning hos barn mellom 7-13, samt mulighetsstudier for de så ung som 2. Den nåværende FDA-godkjenningsbrevet angir spesielt at 670G ikke skal brukes til de yngre enn 7 år, eller hos dem som tar mindre enn 8 enheter insulin per dag (da enheten krever at minimum per dag skal fungere trygt). Metronic sier at den ikke har nok data til de som tar mindre enn 8 enheter per dag for å vite om algoritmen er effektiv og sikker.
Tilgjengelighet og kostnad
Med den mye raskere enn forventede reguleringsgodkjenningen, forteller Medtronic oss at de trenger minst seks måneder til å prep for USAs produktlansering fra våren 2017. For de utenfor statene sier Medtronic å regne med godkjenning en gang i midten av 2017.
Det er mange "bevegelige deler" som må være på plass før lanseringen her i Amerika, forklarer de, pluss at de for øyeblikket ligger midt i Minimed 630G-lanseringen; den forrige modellen begynte nylig frakt til pasienter i USA.
Ja, det vil være en oppgraderingsbane for alle som bruker dagens Medtronic-produkter - kalt Priority Access Program. Det er faktisk oppmuntrende kunder å starte på Minimed 630G i de kommende månedene før 670G treffer markedet, og annonserer at en overgang som dette vil hjelpe pasientene til å trene for den nye plattformen og potensielt redusere sine ut-av-lommekostnader til lavt som $ 0.
- Prioritert tilgangsprogram for innledende kostnad = $ 799
- Innleveringskreditt på MiniMed 630G pumpe og CGM-system = $ 500
- Totalt ut av lommeprogram koster = bare $ 299
- Deltakende i spørreundersøkelser og andre tilbakemeldingsprogrammer for brukere kan redusere også denne prisen til så lite som $ 0 for noen mennesker, sier selskapet.
Prioritetsprogrammet går gjennom 28. april 2017. Medtronic sier også at flere tilbud og oppgraderingsmuligheter kan bli avslørt nærmere lanseringsperioden våren.
Medtronic vil selvfølgelig også jobbe i de kommende månedene med betalere og forsikringsselskaper på dekning for denne teknologien. Med all den siste kontroversen over disse problemene (#DiabetesAccessMatters) håper vi Medtronic husker på at mens mange pasienter vil ha dette systemet, er det kanskje ikke det beste valget for alle - og valgmuligheter!
"En Watershed Moment … Transforming Diabetes Care"
JDRF utgitt en pressemelding på onsdag, noe som uttrykte spenning om denne landemerketeknologien og hvor raskt FDA flyttet. Den amerikanske diabetesforeningen chimed også inn med en pressemelding om denne godkjenningen, og noterte dens betydning.
Tenk på det: For ti år siden trodde mange fortsatt at et lukket sløyfesystem av noe slag var en pipedream. Men JDRF la ut en reell plan for å bevege seg mot en kunstig bukspyttkjertel. Det var fortsatt de aller første dagene av CGM-teknologien … og se hvor langt vi har kommet!
"Dette flyttet utrolig raskt, og det viser hvor viktig alt det harde arbeidet var som vi gjorde på politikksiden tilbake på dagen, for å skape veiledning for disse systemene," sa Kowalski, som personlig spilte en viktig rolle i å gjøre AP tech utvikling en prioritet."Det forandret alt og skapte en vei, og nå er vi her. Det er massivt, virkelig et vannskilt som har potensial til å transformere diabetesbehandling!"
Enten du vurderer Minimed 670G en "kunstig bukspyttkjertel" eller ikke, er nesten ved siden av punktet … Faktum er at vi har en enhet nå som lukker sløyfen på måter vi ikke har sett før, utgjør en tidlig AP-generasjon. Det er potensielt livsendrende teknologi som er gjort tilgjengelig på rekordtid.

FDA ga faktisk markedsgodkjenning for denne Minimed 670G, samtidig som det kreves ytterligere ettermarkedsundersøkelser for bedre å forstå hvordan enheten fungerer i virkelige omgivelser. Det viser at FDA er villig til å se på eksisterende data og stole på fordelene, uten å holde tilbake for reams av fremtidige data.
Reisen er ganske utrolig, som fanget i dette innlegget av D-mamma og lenge JDRF fortaler Moira McCarthy Stanford om hvordan organisasjonen banet vei til denne milepælen og videre.
Vi snakket også med Jeffrey Brewer, som leder opp Bigfoot Biomedical som utvikler sitt eget lukkede system som forventes å være tilgjengelig en gang i 2018. Sammen med Aaron Kowalski anses Brewer å være en av "AP-fedrene" gitt sin rolle i å bidra til å utvikle og fremme den lukkede loopbanen på JDRF.
"Vi er glade for at FDA beveger seg raskere og er mer støttende til automatiserte insulinleveringssystemer, og vi ser ut til å bli hjulpet av de samme vindene!" Brewer fortalte oss.
Dette vil uten tvil flytte nålen fremover på de mer enn 18 andre lukkede systemene i arbeidene - spesielt de som bare bruker insulin. Noen legger til det ekstra hormonet glukagon i blandingen for å bekjempe hypoglykemi (som Beta Bionics iLET og Pancreum Genesis), som kan kreve mer FDA evalueringstid.
Vi er glade for å høre våre venner i gjør-det-selv-fellesskapet på #OpenAPS er også glade for denne nyeste godkjenningen, og hva det betyr for oss alle.
Det er flott å se at FDA beveger seg så fort, ikke bare på denne Minimed 670G-godkjenningen, men med andre spennende diabetesteknologiske og datautviklinger de siste årene. Det er klart at FDA gjenkjenner #WeAreNotWaiting-bevegelsen, og gjør sitt beste for å holde tritt med disse raske tider.
FDA godkjenner Libre Pro
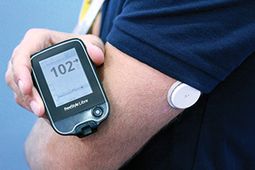
Dette er ikke en forbruker enhet, men klinikeren versjonen av Abbott Ny Flash Glucose Monitoring (FGM) teknologi som allerede er tilgjengelig for pasienter i utlandet.
Abbott Libre består også av en liten rundt sensor som brukes i opptil 14 dager på baksiden av overarmen, og en kontroller som brukerne bare sveiper over det så mange ganger per dag etter behov eller ønsket å ta trådløse glukoseavlesninger.
Det gir ingen alarmer for å øke eller slippe glukosenivåer, og forbrukerversjonen i utlandet lagrer bare 8 timers data.Målet er å skape en enklere overvåkingsløsning som også kan hjelpe mange type 2-er å ha mer kontakt med glukosene i realtid.
Selv om det ikke er en tradisjonell CGM som vi vet, sier Abbott at reguleringsreglene klassifiserer Libre som en CGM. Og det de har godkjent nå, er en versjon som er designet spesielt for leger å låne til pasientene for kortvarig bruk, og det gir bare blinde data for legene å se. Det er et første skritt mot forbrukerversjonen, som Abbott også nylig har arkivert for FDA-godkjenning her i USA.
Forhåpentligvis kommer det snart, med FDAs tilsynelatende eskalerte innovasjonsspor.
En stor takk til alle involverte - ikke minst de hos FDA - for å flytte disse viktige diabetespleieverktøyene fremover i alle våre beste interesser!
Ansvarsfraskrivelse : Innhold opprettet av Diabetes Mine-teamet. For flere detaljer klikk her.Ansvarsfraskrivelse
Dette innholdet er opprettet for Diabetes Mine, en forbrukerhelseblogg fokusert på diabetessamfunnet. Innholdet er ikke medisinsk gjennomgått og overholder ikke Healthlines redaksjonelle retningslinjer. For mer informasjon om Healthlines partnerskap med Diabetes Mine, vennligst klikk her.
Test-Testing Medtronic 670G Diabetes Closed Loop System

En Minnesota-mann er en av bare 15 personer som er en del av en nåværende studie på Minimert 670G, forløper til et kunstig bukspyttkjertelsystem.
En dypere titt på Medtronic Minimed 670G | DiabetesMine

Wil Dubois fullfører sitt tre måneders forsøk på Medtronics nye Hybrid Closed Loop diabetes teknologi, og har noen stumme meninger på denne enheten.
Diabetes Produktanmeldelse: Medtronic 670G Hybrid Closed Loop

DiabetesMine evaluerer den nye Minimed 670G hybrid-sløyfen fra Medtronic Diabetes - et første generasjons system av kunstig bukspyttkjertelteknologi.


